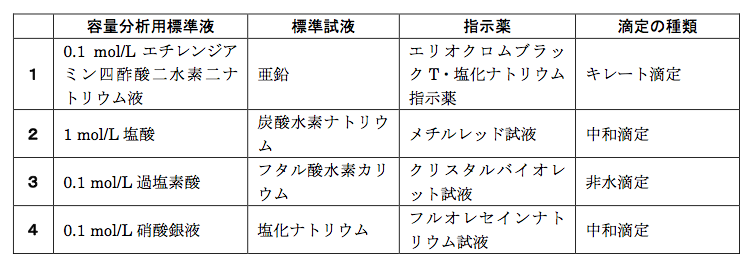
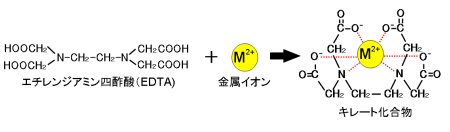
I キレート滴定による亜鉛イオン濃度の決定 1 キレート滴定におけるチオ硫酸ナトリウムの役割を説明せよ。 2 滴定の結果に基づき試料中の亜鉛イオンの濃度を求めよ。 ii ヨウ素還元滴定による銅イオン濃度の決定 1 滴定過程の化学反応式を書け。 2キレート滴定キレートてきてい 試料物質(主として金属イオン)が適当なキレート試薬と反応して キレート化合物 を生成することを利用した滴定法。 1945年Gシュワルツェンバハが創始。 代表的なキレート試薬としては エチレンジアミン 四酢酸滴定の種類:キレート滴定(光度検出) (銅、鉄、亜鉛のマスキング) 試薬の取扱に注意! ④ 10W/V%-塩酸ヒドロキシルアミン溶液5滴を加えます。 計算式

比色試薬 金属指示薬 Xo 同仁化学研究所
キレート滴定 計算 亜鉛
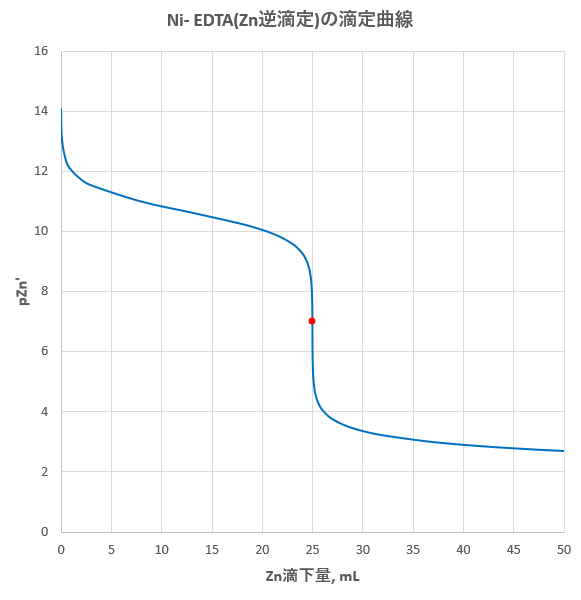
キレート滴定 計算 亜鉛-ムおよび亜鉛ではEDTA錯塩の方がシアノ錯塩よりも 金属イオン濃度が小さく(弟1,2表参照)例えばZn (CN)4 の場合〔CNlが6×10~3モルでNa2ZnY錯 垢と平衡になる。(01モルの場合)。後 の滴定操作に従 う場合,銀,銅および亜鉛またほカドミウムの全部をシキレート滴定の手法は、「銅及び銅合金中のニッケル定量方法」jis h 1056 を参照し、一定量の edta を加えてニッケルの edta 錯体を生成させた後、過剰の edta を亜鉛の溶液で滴定するという、逆滴定を採用しました。 ただし亜鉛の標準溶液を作るのが手間なの




Wo18 号 ハロゲン化亜鉛水溶液の製造方法 Astamuse
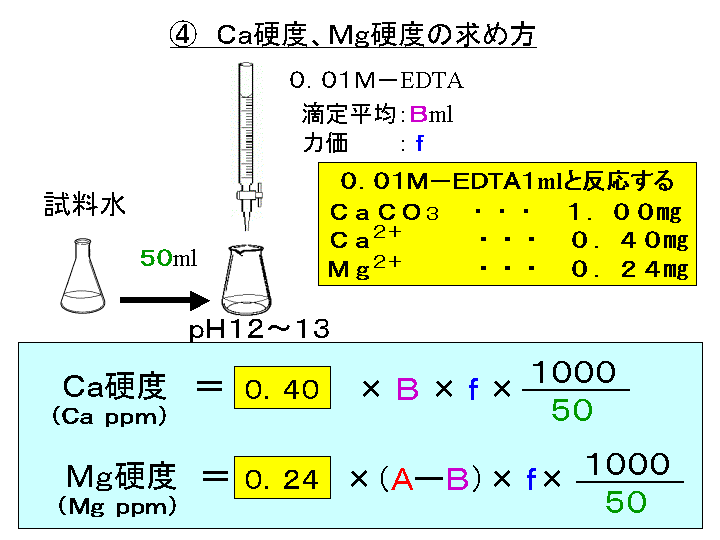
亜鉛イオン(Zn2)は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定が できるpH 領域(pH45~10)は広くかつEDTA に対する安定度定数も大きく、鋭敏に変色する 指示薬も多水の硬度とは、水に溶けているCa 2+ およびMg 2+ の量をCaCO 3 (ppm)に換算したものである。 硬度には、全硬度(Ca 2+ とMg 2+ )、Ca硬度、およびMg硬度がある。 EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合し属を電析させる都合の良い薬剤であり,銅に限らず亜鉛 や金,銀めっきで多用されている。特に銀イオンは電析 しやすいので,銀めっき液には高濃度のシアンが使用さ れる。一方,ニッケルなど鉄属のめっき液にシアン化物 浴は存在しない。
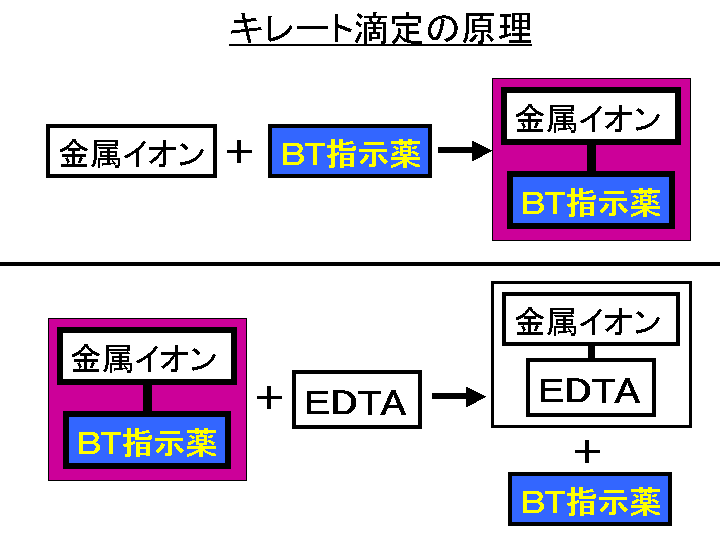
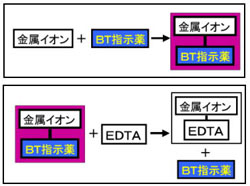
キレート滴定 計算 亜鉛 また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。 I キレート滴定による亜鉛イオン濃度の決定 1 キレート滴定におけるチオ硫酸ナトリウムの役割を説明せよ。√ダウンロード キレート滴定 計算 キレート滴定 計算 亜鉛 キレート滴定法を実際試料の分析に応用する場合,そ の成否を左右する最も大きな要素は,滴 定の選択性をい かにして高めるかにあるといっても過言ではないな ぜ なら,edtaを 用いるキレート( ) キレート滴定の場合、滴定量は、01 ml の単位まで正確に読み取ればよい。 ( ) キレート滴定の場合、滴定量は、001 ml の単位まで正確に読み取り、小数以下二桁目は四 捨五入してもよい。
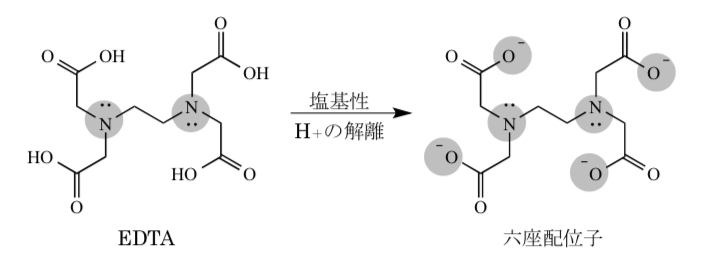
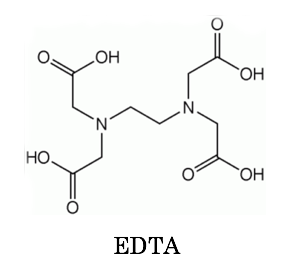
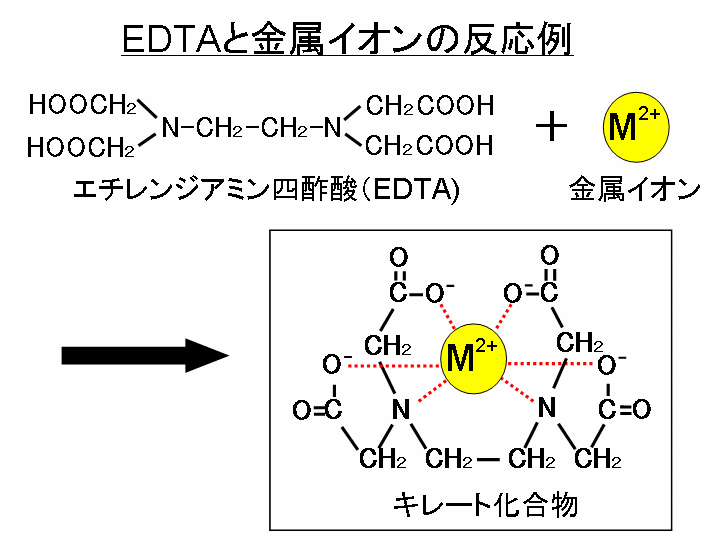
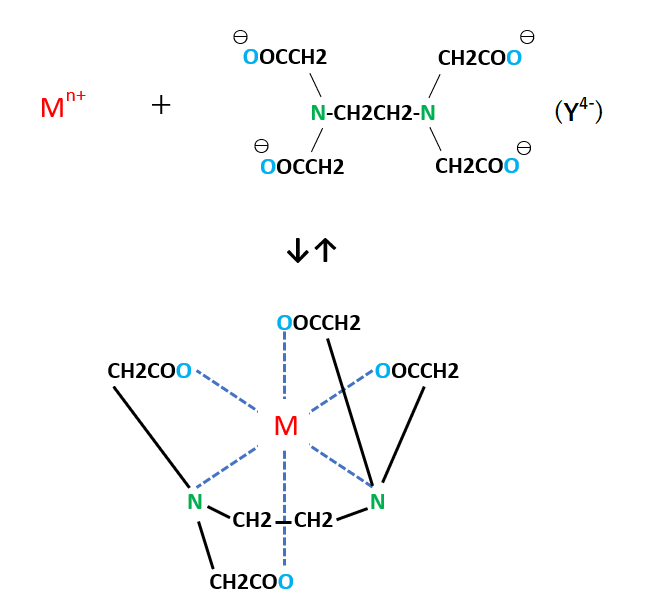
キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数滴定液名 01mol/L EDTA 電極名 自動入力先パラメータ 無し 滴定条件例 滴定曲線例 測定結果 測定回数 試料量(mL) 滴定値(mL) 濃度(g/L) 1 5 7623 9639 2 7603 9614 3 7622 9638 4 7611 9624 5 7595 9603 平均値 : 962g/L 統計計算 標準偏差 : 002g/L3.edtaによるキレート滴定 競技では,edtaによるキレート滴定の原理やebt指示薬やnn指示薬を用いてca2+ やmg2+ を定量する具体的な方法を問題文の1,2ページに記載し,初学者にも充分理解で きるように配慮した。次に実験操作の手順を簡潔に示す。




キレート滴定




Rec Realeducationcompany 大阪市 Education Medical Company Facebook
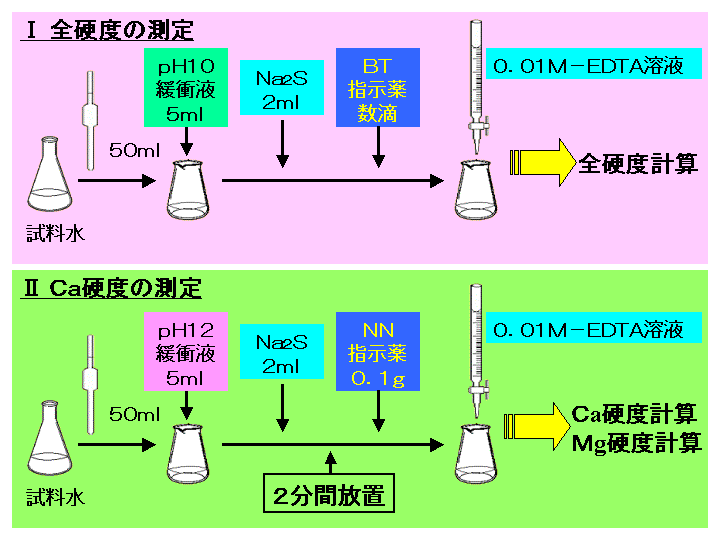
示薬としてedta溶液で滴定し,edta溶液の正確な濃度を決定する。 4.キレート滴定によるca2+とmg2+の定量 試料水にph 10緩衝液を加え,edta溶液とebt指示薬を用いてキレート滴定を 行い,試料水に含まれるca2+とmg2+の合計量を定量する。滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法



年11月発行 カルシウム塩のキレート滴定について




1 3キレート滴定 亜鉛 Ii Edta 塩化銅 Ii Edta のキレート滴定法を学ぶ
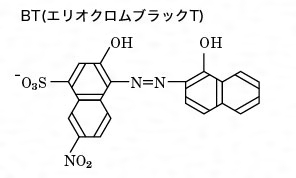
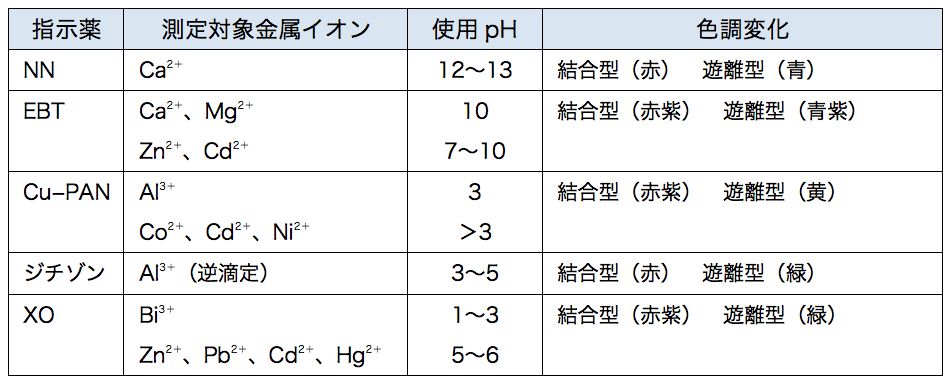
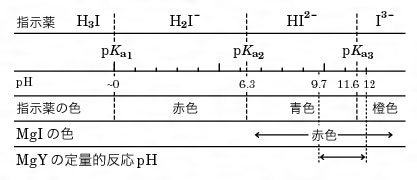
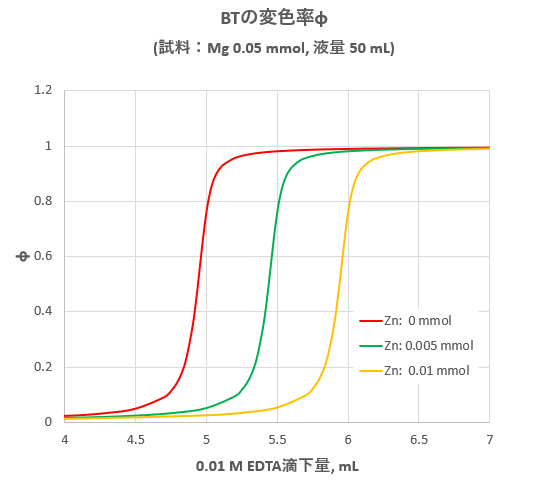
キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63錯体・キレート平衡の計算問題 その1演習問題 このときの濃度は亜鉛イオンに制限され、Zn(NH3)4^2 = mol/L で、アンモニアの濃度はほぼ変化していないとみなし(近似し)005molのままと考えます。連続キレート滴定の溶液化学的考察 天 満 照 郎※ 鉄,アルミニウムおよび亜鉛の各イオンを含む溶液に対しEDTA 標準溶液でもって連続 程式をもとに計算して作成された Kielland



水の硬度測定 キレート滴定



3回生実験のこと 合金の分析4
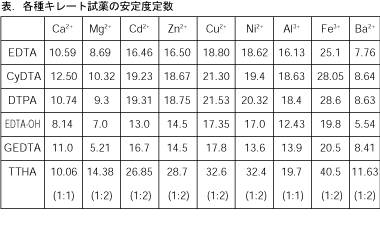
キレート滴定 計算 銅JPB2 JPA JPA JPB2 JP B2 JP B2 JP B2 JP A JP A JP A JP A JP A JP A JP B2 JP B2 JP B2 Authority JP Japan Prior art keywords concentration solution copper plating ion chelating agent Prior art date Legal statusEDTA と金属キレートのK f 値→p18, 表12 <例:EDTA とMg2> K f = 49×108 log K f = 8 log 49金属イオンの滴定法をキレート滴定法と呼ぶのもそのた めです 3 滴定試薬としての応用(キ レート滴定法) 3・1 キレート滴定法の原理 ふたたび反応式(iii)に ついて考えてみましょう あ る金属イオン(m)の 水溶液にedta溶 液(y)を 滴キレート滴定法は,金属キレート錯体の生成反応を利用して,金属イオン を定量する方法である。たとえば,水道水など飲料水中に含まれるマグネシ ウムおよびカルシウムイオン濃度,すなわち,水の硬度はedta を用いる キレート滴定によって簡単に測定




Wo18 号 ハロゲン化亜鉛水溶液の製造方法 Astamuse




灰中の酸化カルシウム
Edta滴定によるアルミニウムの定量について1 マンガンの共存における アルミニウムの逆滴定法 一土壌分析への応用一 新名謹之助的 1序言 土壌・土壌粘土または土壌抽出液中のアルミニウムの直接的*定量法としては,筆者はすでに前報5)6)平成27年度 分析化学学生実験 分光光度法 担当:生体分析化学 松森 信明 木下 kinoshi祥尚 < @chemkyushuunivjp> 2 放射能分析 担当:環境動態化学 杉原真司 15キレート滴定 エチレンジアミン四酢酸(edta、h 4 yと略記)は、水溶液中で金属イオンと反応し、 非常に安定な金属キレート化合物を作る。 キレート滴定は、そのことを利用した容量分析法である。キレート生成反応は、 である。




自動滴定装置データ資料 亜鉛イオンの定量 Hiranuma イプロスものづくり



水の分析
が,ph6に おいて亜鉛,カ ドミウムのうち,カ ドミウ ムのみと安定なキレートを生成して,edtaに よるキ レート滴定からいんぺいすることが知られているす な わち鉛と同量以下のカドミウムは,ジ メルカプビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。問題28 キレート滴定法による銅と亜鉛の定量 合金は、日々の生活の様々な場面で使用されている。とりわけ、その特性(たとえ ば伝導性,機械的特性あるいは耐食性など)により、合金は航空学,建




1 3キレート滴定 亜鉛 Ii Edta 塩化銅 Ii Edta のキレート滴定法を学ぶ



1
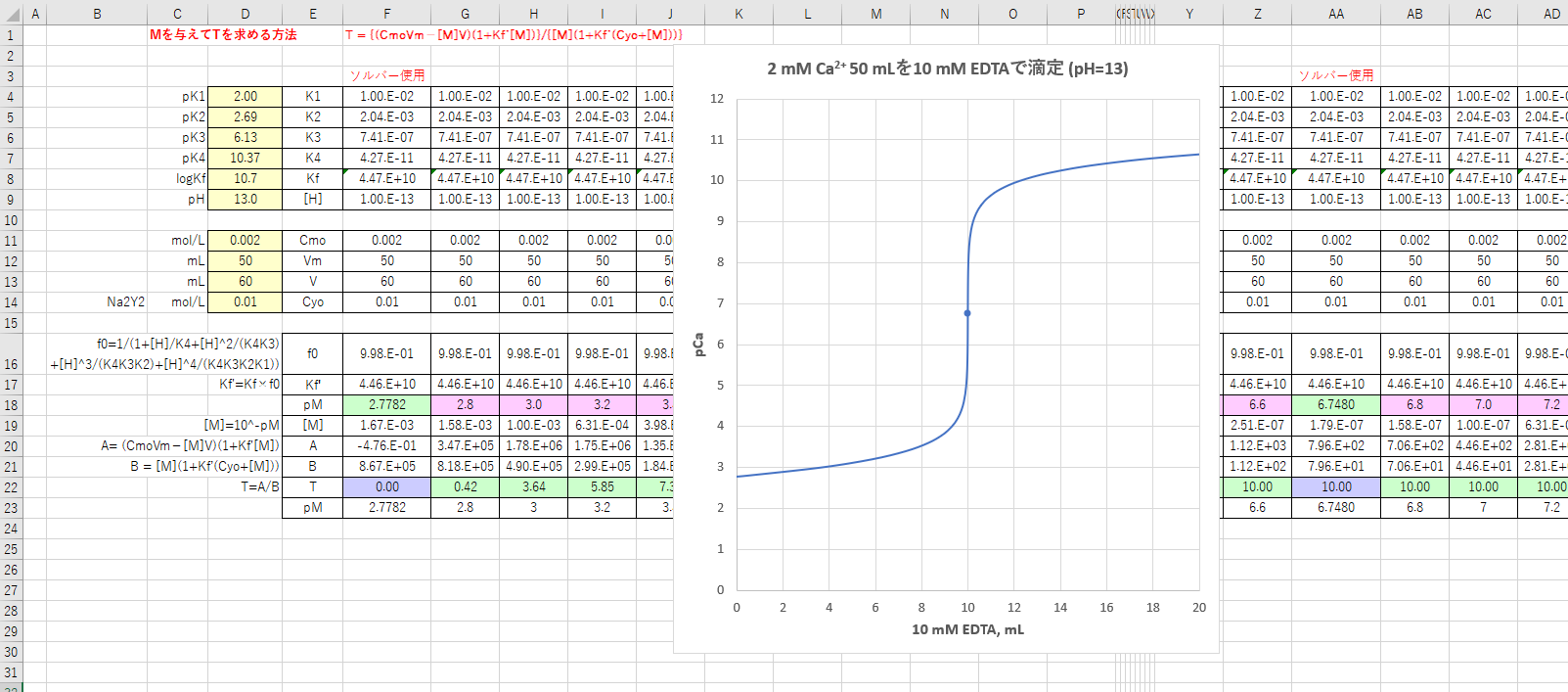
キレート滴定の基礎(Ⅰ) 31 滴定剤の適否 (例1)アンモニアで(i)ヒドロニウム・イオン, (ii)亜鉛イオンを滴定した場合,タテ軸に(i)pH, (ii)pZn をとり,ヨコ軸に滴定剤と被滴定溶液のモ ル比をとれば,Fig4 のようになる。(i)ヒドロニウ滴定の結果、EDTA 15.42mlを要し、0.01Mとした計算値 10.00/0.6537=15.30ml と比較して、0.01M EDTA = 0.M と標定された。亜鉛,カドミウム,コバルト,銅,鉛,マンガン標準液のedtaキレート滴定法に基づく,亜鉛を基準物質とするトレーサビリテイ 著者 日置,昭治他 出版者 日本分析化学会 出版年月日 掲載雑誌名 分析化学 38(9) 提供制限 インターネット公開 原資料(url)



乳酸亜鉛三水和物 Zinc Lactate Trihydrate 266 詳細情報 試薬 富士フイルム和光純薬



5970 45 6 酢酸亜鉛二水和物 99 9 Zinc Acetate Dihydrate 99 9 262 264 詳細情報 合成 材料 試薬 富士フイルム和光純薬
キレート滴定による銅と亜鉛の定量 調整した真鍮の試料溶液5cm3を001mol/L EDTA標準溶液で3回滴定を行った。 3回の滴定の平均は95mlであった。 Cu2+とZn2+のいずれもが、それぞれ1:1でEDTAとキレート化合物を作る1)ので、 キレート滴定の実験で行った水の硬度の求め方について 大学でキレート滴定の実験を行ったんですが水の硬度がうまく計算できなくて教えていただきたいです 大学では アメリカ硬度=検液のモル濃度××1000 ドイツ硬度=検液のモル濃度×5608×1000×(100EDTA と金属キレートのK f 値→p18, 表12 <例:EDTA とMg2> K f = 49×108 log K f = 8 log 49 = 869 ML n M Ln 8 キレート滴定 多座配位子EDTA(標準液)が 金属イオン(Zn 2, Mg 2, Ca , Al3, Cu 等)と 水溶液中で安定な可溶性のキレート化合物を生成する ことを利用した



水の硬度測定 キレート滴定



Hiranuma Com
水道水の総硬度測定はキレート滴定(光度検出)で行います。 (銅、鉄、亜鉛のマスキング) 取扱注意! ⑥ EBT指示薬溶液0.5mlを加え、0.01mol/L-EDTA溶液で滴定します。(赤→青) 計キレート滴定ではpH により試料と滴定試薬との反応性が変化するため、pH 調節は規定通り ・コバルト、ニッケル、銅、亜鉛、カドミウム、水銀 : 80g/Lシアン化ナトリウム溶液2mLを添加 上記の計算式で、カルシウム、マグネシウムの合量およびXIII6 キレート滴定法各論 *過量の EDTA を002 mol/L 酢酸亜鉛洷で滴定(要空試験)。 002mol/L EDTA ・Na 2 洷1mL ≡2721 mg CaHPO 4 計算 x:含量% w:秤量値 v:滴定値 v0:空試験値 f:酢酸亜鉛標準洷の factor w×1000 ×



薬剤師国家試験 第105回 問92 過去問解説 E Rec わかりやすい解説動画




キレート滴定 Yakugaku Lab
キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。




キレート滴定




キレート滴定 Yakugaku Lab




水の硬度測定 キレート滴定




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



水の硬度測定 キレート滴定



亜鉛のedta滴定 2 滴定曲線 溶解度などーエクセルを用いて




Wo18 号 ハロゲン化亜鉛水溶液の製造方法 Astamuse




自動滴定装置データ資料 亜鉛イオンの定量 Hiranuma イプロスものづくり




17 号 キレート剤の定量方法 Astamuse



比色試薬 金属指示薬 Xo 同仁化学研究所



水の硬度測定 キレート滴定




京都大学 化学実験操作法 操作法 2 4 キレート滴定 Mg イオンの定量 Youtube




ミネラル サプリ キレート 滴定



比色試薬 金属指示薬 Xo 同仁化学研究所



薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download




Pdf Ck 19 Kh



キレート滴定とは コトバンク



質問箱



Dojindo Co Jp




キレート滴定



キレート滴定の問題です よろしくお願いします Yahoo 知恵袋




Metal Limited Growth Of Neisseria Gonorrhoeae For Characterization Of Metal Responsive Genes And Metal Acquisition From Host Ligands Protocol Translated To Japanese




17 号 キレート剤の定量方法 Astamuse




自動滴定装置 技術資料 銅イオン選択性電極を用いたキレート滴定 メトロームジャパン Powered By イプロス



キレート滴定 Yakugaku Lab



キレート滴定 Yakugaku Lab



薬剤師国家試験 第98回 問96 過去問解説 E Rec わかりやすい解説動画




Wo17 1428号 金属担持高分子 Astamuse




自動滴定装置 技術資料 銅イオン選択性電極を用いたキレート滴定 技術資料 事例集 カタログ メトロームジャパン Powered By イプロス



キレート滴定の問題で Bt指示薬を使ってcaとmgの混合溶液のmgだけの濃度 Yahoo 知恵袋



2cのページ




キレート滴定法の意味 用法を知る Astamuse




キレート滴定 薬学 これでok




キレート滴定 Yakugaku Lab



キレート滴定とは コトバンク
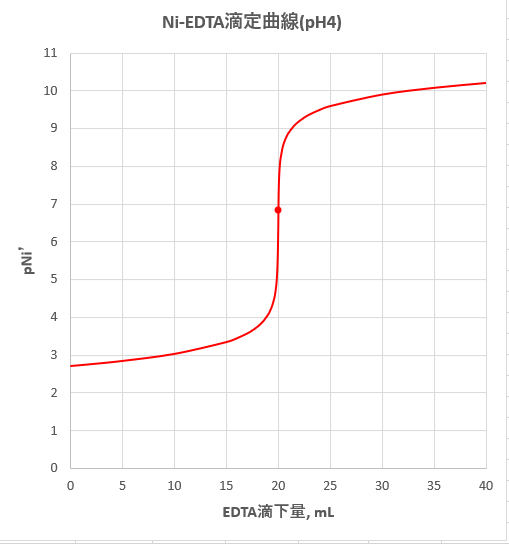



Edta 滴定曲線 溶解度などーエクセルを用いて




キレート滴定 Yakugaku Lab




上 キレート滴定 考察 キレート滴定 カルシウム 考察



水の硬度測定 キレート滴定



Edta 滴定曲線 溶解度などーエクセルを用いて




キレート滴定 Yakugaku Lab



3回生実験のこと 合金の分析



キレート滴定 Yakugaku Lab



Sucra Repo Nii Ac Jp



Fumi Theory Com



水の硬度測定 キレート滴定



2cのページ




資料広場 代表キーワード キレート滴定 全ての種類 最新資料 詳細リスト ハッピーキャンパス



Customs Go Jp




黒田真生 Naoki Kuroda Su Twitter 正答 1 2 3 エリオクロムブラックt 塩化ナトリウム指示薬である 4 亜鉛 とedtaがキレートを作ることによる 5 亜鉛とedtaは1 1で結合するから 0 05 81 38 40 69となる




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ




キレート滴定 Yakugaku Lab




キレート滴定



Column



化学キレート滴定の問題です 赤線引いたところの意味がわかりません Yahoo 知恵袋




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて




比色試薬 金属指示薬 Xo 同仁化学研究所



Edta 滴定曲線 溶解度などーエクセルを用いて




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ




キレート滴定に用いられる主な標準液 指示薬のゴロ 覚え方 ごろごろ覚える薬学生ゴロ 薬剤師国家試験対策
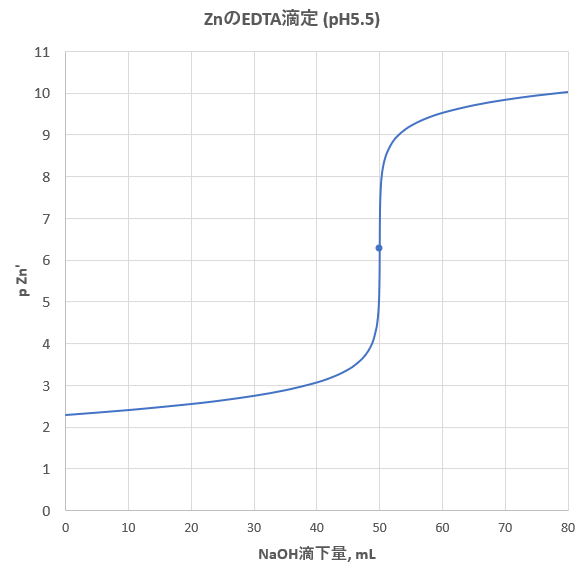



亜鉛のedta滴定 2 滴定曲線 溶解度などーエクセルを用いて




キレート滴定 英語 意味 英語訳 日本語の例文



ジンコンとは コトバンク
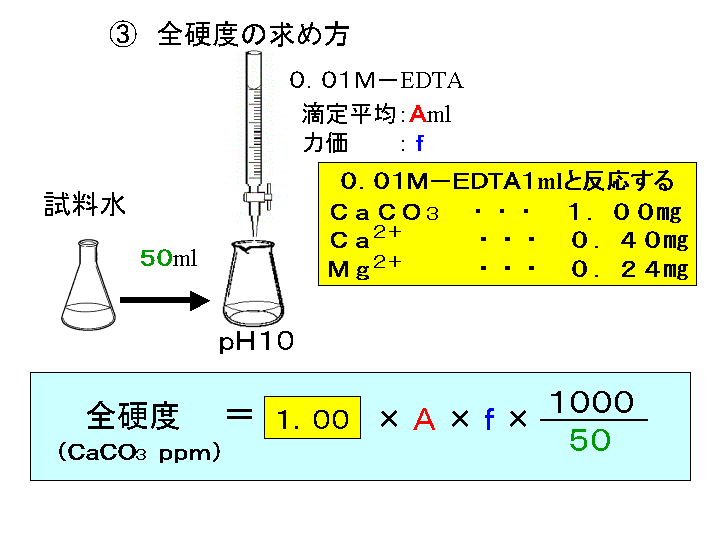



水の硬度測定 キレート滴定
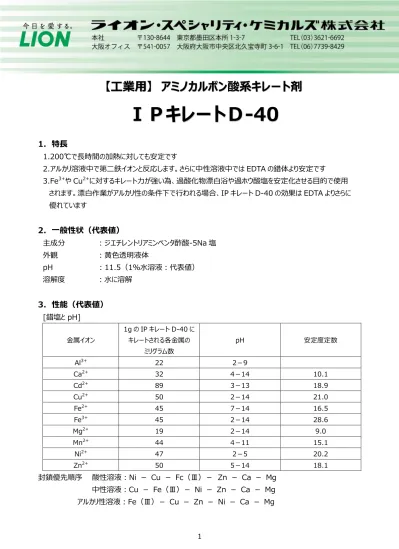



キレート滴定



N Analytech Co Jp



水の硬度測定 キレート滴定



1314 22 3 過酸化亜鉛 Zinc Peroxide 265 267 269 詳細情報 試薬 富士フイルム和光純薬




17 号 キレート剤の定量方法 Astamuse




亜鉛標準原液 Zn 1000 Zinc Standard Stock Solution Zn 1000 260 001 詳細情報 医薬品 製造 品質管理 試薬 富士フイルム和光純薬



キレート滴定の濃度計算問題についてです 解き方がわからないので 教えていただ Yahoo 知恵袋



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて



Fumi Theory Com




比色試薬 金属指示薬 Pan 同仁化学研究所



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量




比色試薬 金属指示薬 Bt 同仁化学研究所




試薬とは コトバンク




第98回薬剤師国家試験 問96 Yakugaku Lab



細胞内の亜鉛の新しい生理的役割が明らかに 亜鉛とシャペロンタンパク質erp44による新しいタンパク質品質管理機構の仕組みを解明 プレスリリース Spring 8 Web Site




亜鉛標準液 Zn 1000 Zinc Standard Solution Zn 1000 260 詳細情報 合成 材料 分析 試薬 富士フイルム和光純薬




136 23 2 ジブチルジチオカルバミン酸亜鉛 Zinc Dibutyldithiocarbamate 263 詳細情報 試薬 富士フイルム和光純薬



3回生実験のこと 合金の分析



キレート わかりやすく



0 件のコメント:
コメントを投稿